Quelles opportunités pour le biocontrôle dans la lutte anti-varroa ?
A. Varroa destructor, l’ennemi public n°1
1) Le varroa au cœur des préoccupations de la filière apicole
Varroa destructor (Anderson & Trueman, 2000) (illustration 2) est un nouveau parasite de l’abeille à miel Apis mellifera (Linnaeus, 1758). Originaire d’Asie, il s’est propagé à travers le monde entier en une cinquantaine d’années et a atteint l’Europe en 1980 (GRIFFITHS & BOWMAN, 1981) (Figure 1). Contrairement à la relation avec son hôte d’origine Apis cerana (Fabricius 1793) (Illustration 1), le parasitisme de Varroa destructor sur Apis mellifera est en déséquilibre et cause d’énormes dégâts sur les abeilles (FERNANDEZ et COINEAU, 2002) : une colonie infestée en zone tempérée peut s’effondrer en 2-3 ans (ROSENKRANZ et al., 2009). Le varroa est considéré aujourd’hui, avec les pesticides, comme une des causes principales du déclin des abeilles en Europe (DE LA RUA et al., 2009). L’importance économique du varroa n’est pas chiffrée (probablement non chiffrable) mais il impacte directement les apiculteurs (i) en fragilisant les ruches par la transmission de maladies telles que le virus des ailes déformées (DWV) (mortalité long terme) ou le virus du cachemire (KBV) (mortalité court terme) ainsi que cinq autres virus (SPRYGIN et al., 2016), (ii) en diminuant la production de miel, (iii) en augmentant le coup des interventions (traitements, suivi de l’infestation…). Il impacte indirectement la société et les écosystèmes en privant la flore de ses principaux pollinisateurs : le service écosystémique rendu par l’ensemble des insectes pollinisateurs (avec une proportion variable d’abeilles domestiques selon les cultures, environ 50%) a été chiffré à 153 milliards d’euros (MELATHOPOULOS et al., 2014). L’importance écologique communément donnée aux abeilles domestiques et appuyée par la communauté apicole (les apiculteurs se positionnant comme les garants de la biodiversité), est cependant nuancée par différents auteurs montrant l’impact néfaste des populations d’abeilles domestiques sur les hyménoptères pollinisateurs sauvages dans des paysages agricoles où la place de la flore sauvage est moindre (WESPHAL et al., 2008)(SCHAFFER et al., 1979).

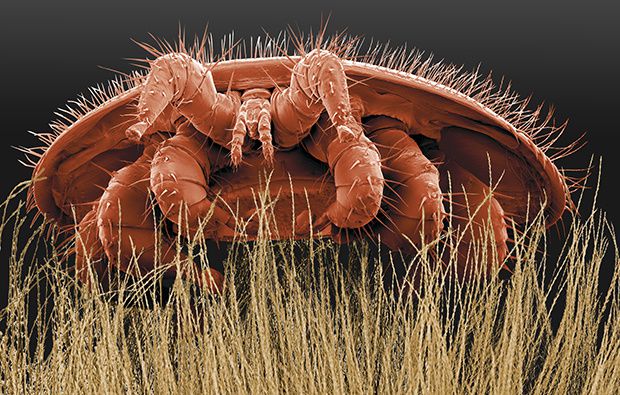

La maladie provoquée par la prolifération de varroa est appelée varroase et est, en France, inscrite dans les maladie animales à déclaration obligatoire (article L. 223-2 du code rural) (wikipédia.org) bien que tous les ruchers connaissent aujourd’hui la varroase et qu’aucun apiculteur ne semble la déclarer (GAUTHIER, 2011).
En France, la lutte contre le varroa est au centre des préoccupations de la filière apicole : la FNOSAD (Fédération Nationale des Organisations Sanitaires Apicoles Départementales) tente de coordonner chaque année la lutte contre le varroa à l’échelle nationale (fnosad.apiservices.biz), une partie du PDDA (Plan de Développement Durable de l’Apiculture) lancé par Stéphane Le Foll soutient les actions de lutte contre le varroa (Ministère de l’agriculture, 2013), l’ITSAP (Institut de l’Abeille) organisait en 2010 une Journée de concertation et d’échange autour du varroa soutenu par FranceAgriMer et le CASDAR (ITSAP, 2010), la FFAP (Fédération Française des Apiculteurs Professionnels) finance des projets de recherche sur la lutte contre le varroa (apipro-ffap.fr), etc. Cette mobilisation massive du monde apicole français témoigne de la difficulté de maîtriser ce parasite c.à.d. l’insuffisance des produits disponibles sur le marché, la nuisibilité du varroa, le besoin en recherche et innovation. L’UIPP (Union des Industries de la Protection des Plantes) rapporte que certains groupes comme BAYER se penchent aussi sur la question (ITSAP, 2010).
2) Description du varroa : morphologie, cycle de développement, dynamique de population
Varroa destructor est un acarien de l’ordre des Mesostigmata (fauna-eu.org). La femelle est de forme ellipsoïdale d’une longueur d’environ 1mm et d’une largeur de 1.5mm ; le mâle, d’une longueur d’environ 0.8mm est en forme de poire (FERNANDEZ et COINEAU, 2002). Le varroa et son dimorphisme sexuel sont donc visibles à l’œil nu (illustration 6).
Le varroa est un parasite obligatoire du genre Apis, il est incapable de réaliser son cycle de développement sur d’autre insectes (KEVAN et al., 1990) et son développement présente un synchronisme fort avec le cycle de l’abeille. Afin de comprendre la relation de parasitisme, nous présenterons le cycle de développement de l’abeille (dans une ruche) puis celui du varroa.


a. Cycle reproductif de l’abeille
(Nous décrivons ici seulement les phases en interaction proche avec le varroa)
Chez les abeilles, on distingue trois « castes » : les ouvrières, la reine et les « faux bourdons » (mâles), chaque caste suit un cycle de développement différent. L’abeille, comme tout endoptérygote (insecte à métamorphose dite « complète ») comprend quatre grands stades de développement : l’œuf, la larve, la nymphe et l’adulte. Les stades qui précèdent l’éclosion se font au sein des alvéoles du couvain (sauf pour la reine). Le couvain est généralement situé au centre de la ruche, les alvéoles (ou cellules) sont horizontales et de section hexagonale, les alvéoles des mâles sont plus grandes que celles des ouvrières. On distingue plusieurs grandes phases de développement. La phase de pré-operculation, durant laquelle le couvain est ouvert : comprend l’œuf et cinq stades larvaires nourris par les nourrices (jeunes abeilles âgées de 3 à 15 jours). Avant la nymphose, une nourrice vient operculer la cellule avec un agrégat de particules. En phase de post-operculation, la larve tisse un cocon (33h à 36h chez l’ouvrière, 48 à 52h chez le faux bourdon), s’ensuit alors la nymphose puis l’éclosion de l’abeille 270 à 290h après l’operculation chez l’ouvrière et environ 330h chez le faux bourdon : l’adulte découpe l’opercule avec ses mandibules et sort de l’alvéole. (FERNANDEZ et COINEAU, 2002), (ROSENKRANZ et al., 2009) (Figure 2).
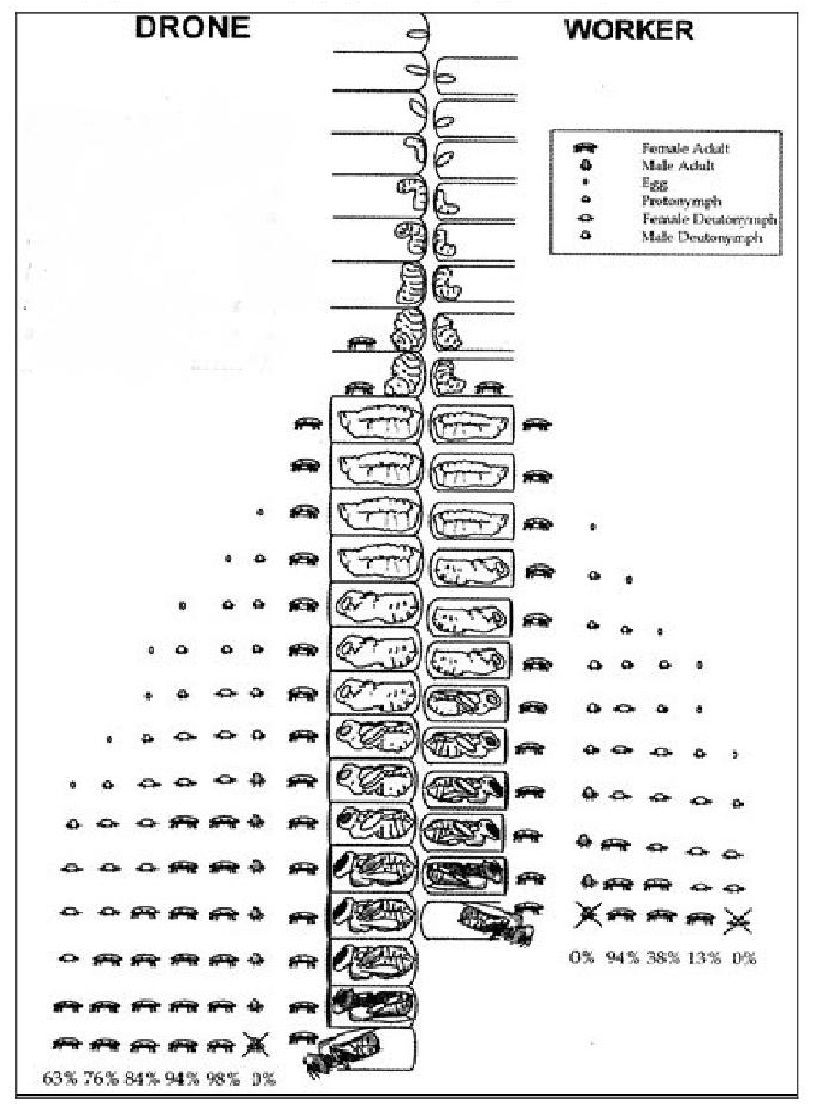
b. Cycle reproductif du varroa
Chez le varroa, on distingue deux grandes phases : l’ontogénèse (Figure 2) qui se déroule dans la cellule du couvain et la phorésie durant laquelle le varroa est hors du couvain.
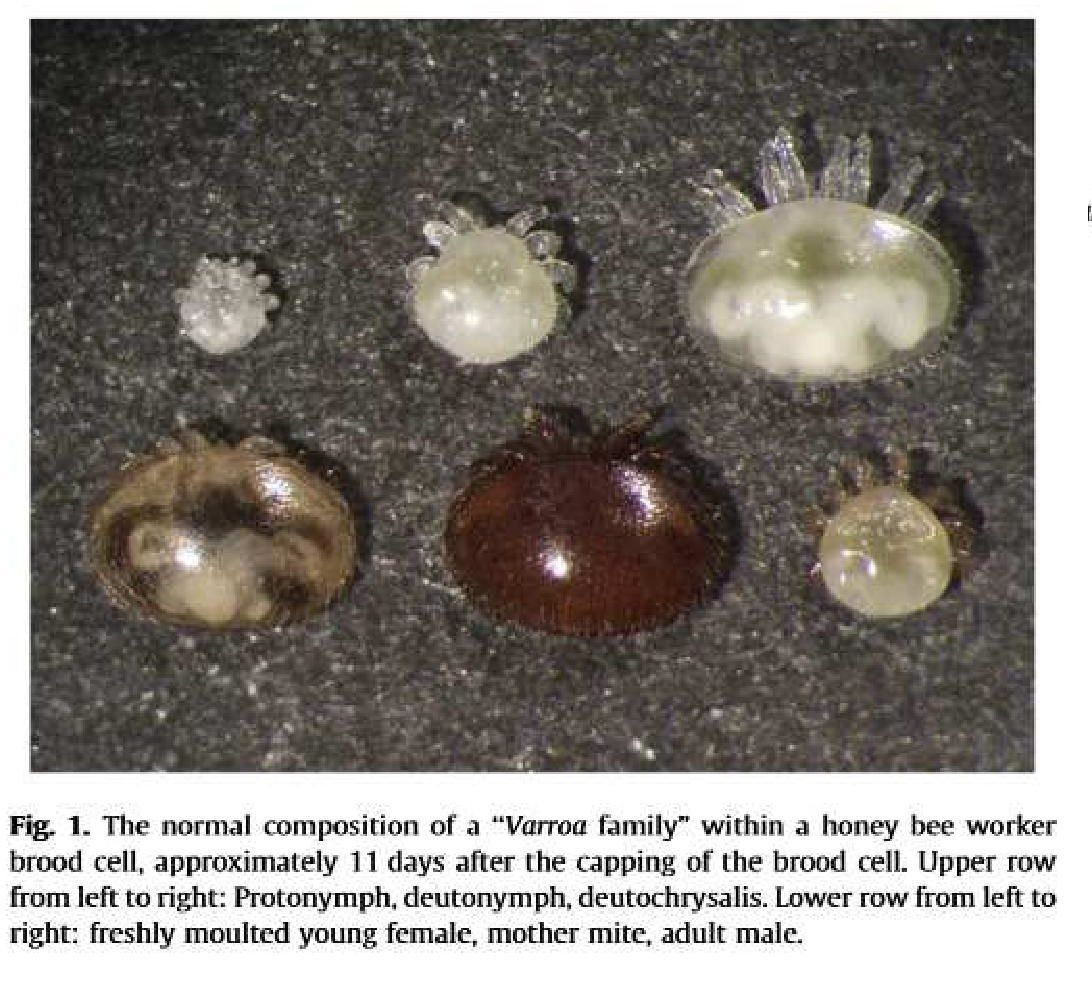
Avant l’operculation de la cellule, une femelle varroa dite « fondatrice », se décroche d’une abeille nourrice sur laquelle elle était fixée pour rentrer dans la cellule, elle se glisse alors sous la larve (au cinquième stade) 20h avant l’operculation chez l’ouvrière et 40h chez le faux bourdon (INFANTIDIS, 1998). Divers composés chimiques sécrétés par la larve d’abeille sont impliqués dans ce processus (LE CONTE et al., 1989). La femelle varroa fondatrice se retrouve au fond de la cellule, à l’abri du nettoyage des abeilles. Dans les cas où l’infestation d’une ruche est importante, les cellules peuvent être pluri-infectées et contiennent alors plusieurs femelles fondatrices (VANDAME, 2000). La description de l’ensemble des comportements du varroa dans la cellule n’est pas nécessaire dans notre cas d’étude ; nous ne relèverons que les points les plus importants. La femelle se nourrit à intervalles plus ou moins réguliers pendant son séjour en perçant la cuticule de la nymphe d’abeille. Au jour 3 après operculation elle pond un premier œuf qui donnera naissance à un mâle, les autres œufs pondus toutes les 30h (DONZE & GUERIN, 1994) donneront tous naissance à des femelles. Le nombre d’œufs pondus par une femelle est variable (multifactoriel), il est d’environ 5 à 6 chez les ouvrières et 6 à 8 chez les faux bourdons (AKIMOV, 1988 in FERNANDEZ et COINEAU, 2002). Le varroa mâle féconde progressivement chaque femelle fille lorsqu’elles atteignent leur maturité sexuelle, puis meurt. A l’éclosion de l’abeille, la femelle fondatrice et les femelles filles sortent avec la jeune abeille ou s’accrochent à d’autres abeilles passant à proximité. Dans 80% des cas, les varroas se fixent sur de jeunes abeilles (nourrices) et dans 20% des cas sur les butineuses qui assurent la dissémination de l’espèce grâce à la « dérive des butineuses » qui se trompent de ruche en retour de butinage. (FERNANDEZ et COINEAU, 2002). Nombreuses anomalies de reproduction du varroa sont reportées dans la littérature (mâle infertile, ordre de ponte modifié, mort précoce du mâle…) et compte 0.34 à 1.82 femelles filles par femelle fondatrice dans les cellules ouvrières et 2.7 femelles filles dans les cellules de faux-bourdon (FERNANDEZ et COINEAU, 2002). On note que 18% des femelles fondatrices sont capables d’effectuer un second cycle, et 4% un troisième cycle soit une moyenne de 1.26 cycle par femelle (MIKITYUK, 1979 in FERNANDEZ et COINEAU, 2002). (Figure 2).
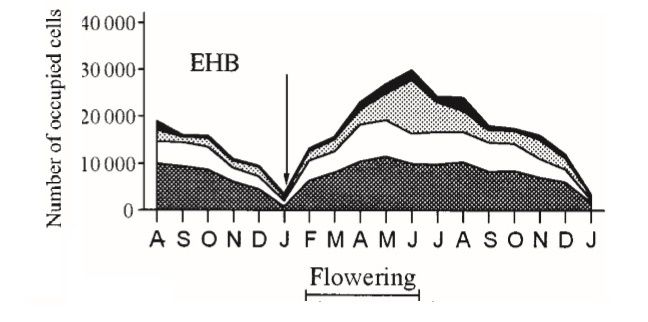

Figure 3 : Utilisation des cellules au cours du temps et évolution relative des varroas phorétiques (phoretic mites) et des varroas en ontogénèse (brood mites) (VANDAME et al., 2000). La flèche indique le moment de l’année où la population de varroa est la plus vulnérable (peu de varroas dans les cellules), cette période est tout aussi préjudiciable pour la colonie car la forte part de varroas phorétiques affaiblie les abeilles et s’additionne aux conditions climatiques les plus froides de l’année. EHB=European Honey Bees

Figure 4 : Evolution annuelle de la population d’abeilles adultes et occupation du couvain au sein d’une colonie (MARTIN, 1998). Drone Brood : Cellule mâle, Worker Brood : cellule ouvrière.
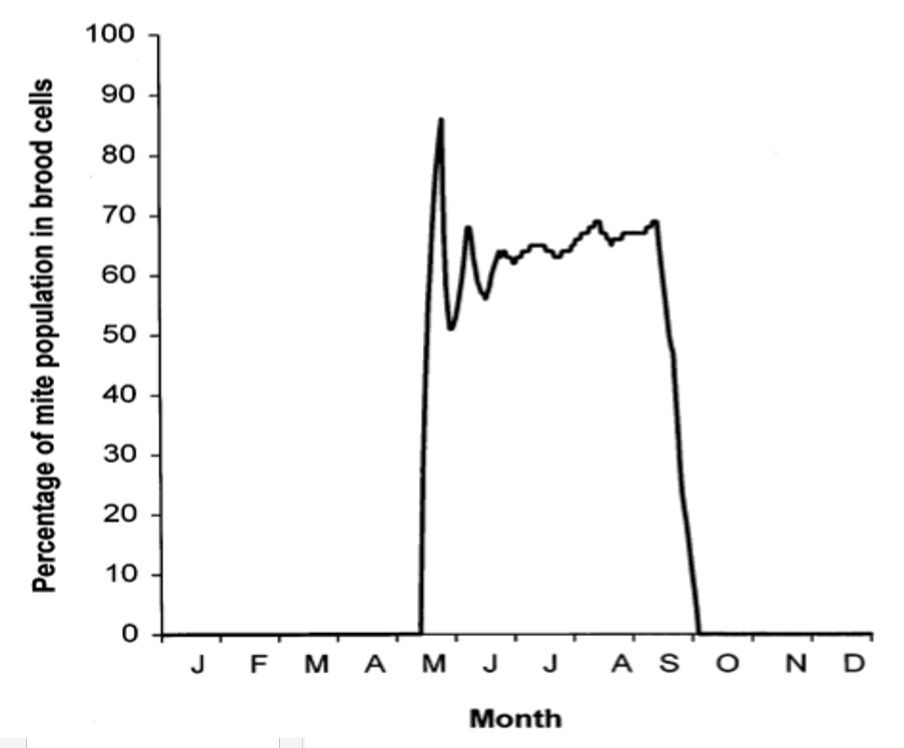
Figure 5 : Modélisation de l’évolution annuelle du pourcentage de la population de varroa dans les cellules (MARTIN, 1998).

Figure 6 : Modélisation de l’évolution annuelle du pourcentage d’infestation des cellules de couvain et des abeilles adultes (MARTIN, 1998).
La phorésie correspond à la période durant laquelle le varroa est hors des cellules du couvain : la plupart des acariens sont fixés sur les abeilles adultes. Cette phase permet la dissémination de l’espèce et la maturation des femelles filles en vue de devenir des fondatrices. La durée de la phorésie semble varier en fonction de l’âge de l’acarien, la saison ou le nombre de couvains disponibles. Certains auteurs décrivent des femelles entrant dans des cellules immédiatement après leur émergence et d’autres des durées de phorésie allant jusqu’à 10.7 jours pour les jeunes varroas et 4.5 jours pour les varroas plus vieux. Dans leur synthèse bibliographique, FERNANDEZ ET COINEAU, 2002 tabulent sur une valeur moyenne de 4.7 à 7.4 jours pour les populations mélangées.
Dans la plupart des méthodes de lutte contre le varroa, seul le varroa en phorésie est accessible et vulnérable. De même, dans le cas d’un biocontrôle, l’interaction varroa/prédateur ne pourra se faire que lors de la phorésie. La quantité de couvain produite par la colonie est saisonnière (Figure 3) (VANDAME et al., 2000) (MAIDANA et al. 2005)(ADJLAN et al., 2015) (MARTIN, 1998) et est variable selon les climats et la météorologie (DE JONG et al. 1984) (KRAUS & PAGE, 1995): les climats à hivers rigoureux sont marqués par une longue période d’absence de couvain (Figure 5) tandis que sous les climats tropicaux, le couvain est présent toute l’année. La quantité de varroas présents dans les cellules est corrélée au nombre de cellules disponibles (VANDAME et al., 2000). Cependant le taux de cellules infectées est très variable d’une situation à une autre et ne semble pas corrélée à la quantité de couvains disponibles (GHAMDI & HOOPINGARNER, 2004) (ADJLAN et al., 2015) (MARTIN, 1998). Ainsi, la quantité de varroas et la proportion de varroa phorétique est saisonnière mais dépend aussi d’interactions complexes de parasitisme, difficilement modélisable ou prédictibles (WENDLING, 2012). Les colonies sont particulièrement en danger lorsque le nombre de varroas phorétiques est élevé (atteint généralement un pic à la fin de la saison de butinage, vers fin octobre en France).
Les traitements d’été visent donc à limiter cette prolifération estivale bien que les varroas dans les cellules sont protégés (sauf certains traitements). Les traitements d’hivers ciblent la période où la population du parasite est la plus vulnérable c.à.d. quand la proportion de varroas phorétiques est la plus élevée (=100% quand il n’y a pas de couvain dans la ruche) (MARTIN, 1998) (FERNANDEZ et COINEAU, 2002).
3) Dynamique de population
L’étude de la dynamique de population de Varroa destructor a fait l’objet d’une grande quantité de publications et de plusieurs tentatives de modélisations qui révèlent la grande complexité de cette relation de parasitisme qui dépend du climat, des phénomènes atmosphériques, de la race d’abeille, des pratiques de l’apiculteur, de la structure de la ruche, de la souche de varroa… Nous ne retiendrons donc que quelques éléments clefs que nous remobiliserons dans cette étude. On considère que le taux de croissance de la population de varroa en présence de couvain est de 0.022j-1 (MARTIN, 1997) (GHAMDI & HOOPINGARNER, 2004) soit une capacité à doubler sa population en 1 mois environ. Certains auteurs ont observé une diminution naturelle de la population en hiver de 50% (FRIES et al., 1994 in FERNANDEZ ET COINEAU, 2002) mais la confrontation avec d’autres sources montre qu’il est plus juste de considérer un taux de décroissance d’environ 0.01j-1(CALIS et al, 1999) (BRANCO et al, 2006). La vitesse d’infestation d’une colonie dépend grandement du nombre de varroas initiaux (déjà présent ou arrivant) (GHAMDI & HOOPINGARNER, 2004) bien que cette dynamique peut être très variable selon les situations (IMDORF et al., 2003). Il ne semble pas y avoir de seuil précis de nombre de varroas dans la ruche expliquant l’effondrement d’une colonie d’abeille (de 3000 à 50 000) (FERNANDEZ ET COINEAU, 2002) : la FNOSAD (organisme sanitaire apicole français) considère que la varroase est préjudiciable à partir de 1000 varroas par ruche (VANDAME, 2015). S’ajoute à cette croissance intrinsèque de la population de varroa une invasion de varroas étrangers allant de 2 par semaine à 5 par jour au printemps et de 30 par semaine à 70 par jour en été : cette invasion est permise par les phénomènes de « dérive des butineuses » et de « pillage » (FERNANDEZ ET COINEAU, 2002). Ainsi, la population de varroas dans une ruche non traitée évolue exponentiellement au fur et à mesure des années et cause irrémédiablement la mort de la colonie (ROSENKRANZ et al., 2009) (WENDLING, 2012), le parasite causant la mort de l’hôte, on parle de parasitisme en déséquilibre (alors qu’il est en équilibre avec l’hôte d’origine Apis cerana).

4) Etat des moyens de lutte anti-varroa.
Nous présenterons ici un panel succinct des techniques utilisées contre le varroa ainsi que leur efficacité respective. Ce paragraphe permettra de discuter de la pertinence technique d’un nouveau produit de biocontrôle dans l’arsenal de techniques existantes.
a. Lutte chimique (au sens large)
De loin la plus utilisée, la lutte chimique concerne en France une petite liste de molécules.
L’amitraz (APIVAR®, APITRAZ®) est l’une des molécules les plus commercialisées en Loire-Atlantique (LANTUEJOUL, 2017) et probablement en France. Elle vise les varroas phorétiques et son taux d’efficacité (Figure 8) est en moyenne supérieur à 95% (ILYASOV et al. 2014) mais cette efficacité est variable selon les situations (Figures 9 et 10). Des phénomènes de résistances ont été observés dans plusieurs localités européennes (KAMLER et al., 2016, SCHMEHL & ELLIS, 2014) et l’ancienneté des pratiques de traitements en France mènent à penser que ces gènes de résistance peuvent s’être développés dans l’hexagone. L’amitraz est toxique pour l’humain et engendre une altération de l’ADN (RADAKOVIC et al., 2013) et il semble impacter négativement la ponte des abeilles (ILYASOV et al.2014). L’utilisation de l’APIVAR® est recommandée par les organismes apicoles et les professionnels que nous avons rencontrés (UNAPLA, GDS44) et bénéficie d’une subvention en 2017. L’APIVAR® fonctionne par diffusion de l’amitraz dans la ruche, c’est un traitement d’été (mise en place début août à fin septembre) qui reste en place 70 jours.
Le tau-fluvalinate (APISTAN®) est une seconde molécule utilisée en traitement d’été. Son mode de fonctionnement est similaire à l’APIVAR® mais son efficacité est moindre (Figures 9 et 10), on observe de même des phénomènes de résistance chez le varroa (KAMLER et al., 2016, SCHMEHL & ELLIS, 2014). Le tau-fluvalinate semble impacter négativement la ponte et la production de miel (ILYASOV et al.2014), tout comme la santé générale des abeilles (FROST et al., 2013, FAEZEL-ORR et al., 2016). L’utilisation de l’APISTAN® bénéficiait d’une subvention en 2016.
L’acide oxalique, un acaricide naturel, a bénéficié d’une AMM récente (2015) pour le produit ApiBioxal ® (anses.fr), il est vendu sous forme de poudre, doit être dilué puis dégoutté sur les abeilles : c’est par contact que l’acide agit. Ce produit est autorisé en apiculture biologique mais dangereux à manipuler et très toxique pour l’homme (GUILLOTON, 2017). Son efficacité sur les varroas phorétiques atteint régulièrement les 98% (CHARRIERE, 1998) et une exposition régulière du varroa à cet acide ne semble pas provoquer de phénomènes de résistance (MAGGY et al., 2016). L’acide est applicable en été (fin août à fin septembre) comme en hiver. Son efficacité est cependant à nuancer car malgré l’éradication quasi-totale de la population de varroa, son action est ponctuelle et les réinfestations sont plus virulentes que sur les traitements à l’amitraz (Figure 12) (VANDAME, 2015). Certains apiculteurs témoignent que ce traitement est violent pour les abeilles et décrivent plusieurs cas de mort de la colonie après application d’acide oxalique (UNAPLA, 2017). Il est intéressant de noter que certains apiculteurs extraient eux-même l'acide oxalique de la rhubarbe ou de l'oseille.
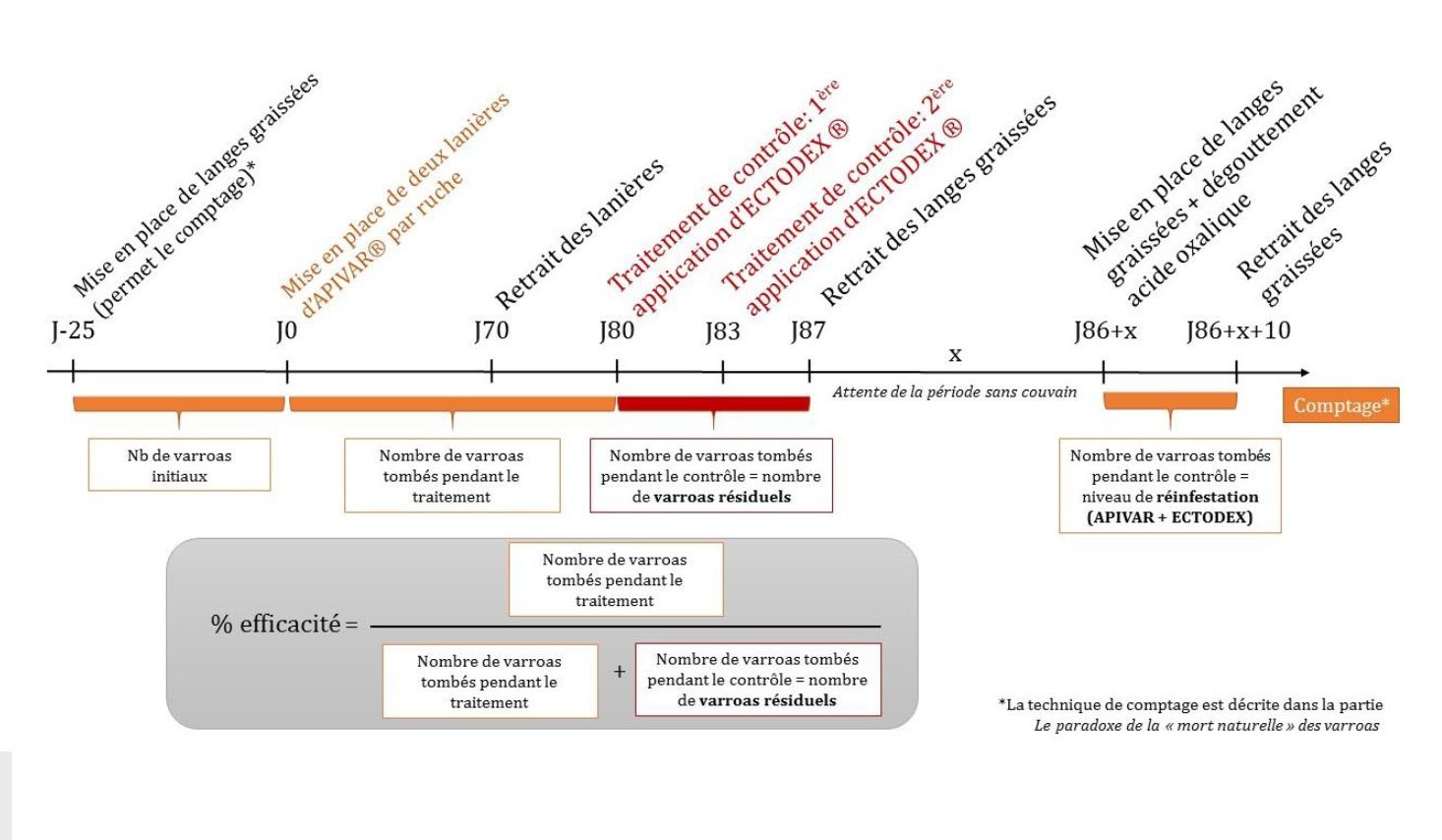
Figure 8 : Exemple d’une conduite de comptage et d’évaluation d’efficacité pour un traitement à l’APIVAR® (amitraz) |

Figure 9 : Taux d'efficacité et répartition du risque après différents traitement (VANDAME, 2015)

Figure 10 : Nombre de varroas résiduels et répartition du risque après différents traitements (VANDAME, 2015)
Le thymol est un composé acaricide naturel présent dans le thym, commercialisé (APIGUARD®, THYMOVAR®) pour lutter contre le varroa et est utilisé principalement par les apiculteurs réticents à l’emploi de molécules de synthèse ou en conduite biologique. Il s’emploie en traitement d’été et nécessite des températures relativement élevées pour une diffusion efficace dans la ruche (IMDORF et al, 1996), cette caractéristique explique probablement l’hétérogénéité de l’efficacité du thymol (80 à 95% en régions méditerranéennes contre 70 à 90% en climat plus tempéré) (ADJLANE et al., 2016) (VANDAME, 2015).
On note l’utilisation de diverses autres huiles essentielles (origan, lavande, camphre, eucalyptus, menthol…) aux efficacités similaires sinon moindre au thymol, l’utilisation de de l’acide formique (MAQS®, FORMIVAR®), qui a la particularité d’affecter les varroas au sein même des cellules operculées mais qui s’accumule dans le miel (FERNANDEZ ET COINEAU, 2002) et divers autres molécules (ou produits) acaricides détournées de leur utilisation d’origine et non autorisées en France en traitement apicole (sauf exceptions) : coumaphos (PERIZIN®), ECTODEX®(amitraz), OXUVAR® ou VARROX®(acide oxalique).
b. Lutte biotechnologique
De nombreuses pratiques alternatives et complémentaires aux traitements sont utilisées par les apiculteurs et présentent des résultats intéressants. Parmi ces techniques nous pouvons citer la sélection d’abeilles résistantes, la réduction de la taille des alvéoles, le blocage de la ponte de la reine, l’utilisation de phéromones (perturbation du comportement du varroa), la thermothérapie, l’élimination du couvain mâle, l’utilisation de fréquences acoustiques ou l’utilisation d’une grille sur le plancher de la ruche pour éliminer tous les varroas chutant (Illustration 7). (FERNANDEZ ET COINEAU, 2002).
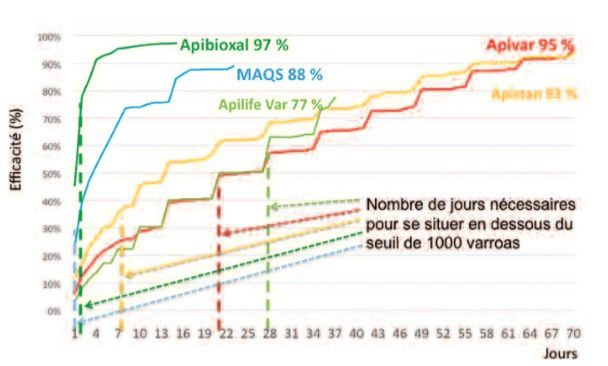
Figure 11 : Cinétique de chute des varroas et pourcentage d’efficacité pour cinq médicaments testés par la FNOSAD en 2015 (VANDAME 2015)
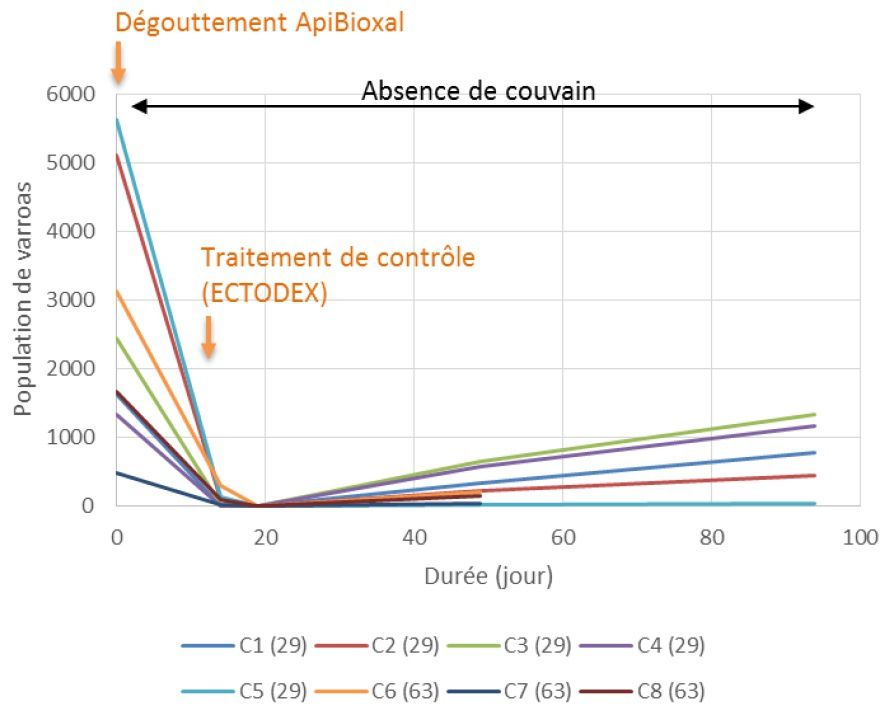
Figure 12 : Dynamique de réinfestation après un traitement à l’ApiBioxal (acide oxalique) pour différentes colonies (VANDAME, 2015)

Illustration 7 : Exemple d’un plancher de ruche grillagé antivarroa. Le varroa tombe et passe à travers les mailles, il est alors incapable de remonter. Le tiroir permet de positionner une lange graissée afin de suivre l’évolution du niveau d’infestation. (http://www.ruchewarre.net)
c. Biocontrôle
Quelques scientifiques ou commerciaux ont porté leurs recherches sur l’emploi de prédateurs, naturels ou non, pour lutter contre le varroa. A cet effet, deux organismes vivants semblent avoir été étudiés : l’acarien prédateur Hypoaspis miles (=Stratiolaelaps scimitus) et le pseudoscorpion (Chernetidae). Les pseudoscorpions semblent être des prédateurs naturels du varroa : leur présence dans les ruches a été observée par plusieurs auteurs (SUBBIAH et al, 1957) tout comme leur activité prédatrice sur le varroa (GONZALES et al., 2007) (READ et al, 2013). Un groupe d’étude indépendant allemand (BeeProject) semble travailler et étudier ces relations mais n’ont produit aucune publication avérant l’efficacité de contrôle du pseudoscorpion. Une petite poignée de chercheurs publie régulièrement sur le thème, montrant des avancées progressives sur la compréhension des interactions entre varroa, abeilles et pseudoscorpion (READ et al, 2013)(DONAVAN & PAUL, 2015)(VAN TOOR et al, 2016). Aucun produit commercial à base de pseudoscorpion n’est présent sur le marché.
Quant à Hypoaspis miles, il est commercialisé comme produit de biocontrôle contre le varroa par KOPPERT, BAYER, BeeVet, Applied Bio-nomics (appliedbionomics.com)… Il est administré par un lâché abondant d’un substrat (illustration 8) contenant l’acarien au-dessus des cadres et d’autres méthodes d’administration semblent être en développement (MASS & MARKX, 2015) ; cependant l’efficacité de cet acarien n’est pas avérée (RANGEL, 2006) et la littérature présentant des essais à ce sujet est inexistante : seuls quelques apiculteurs (et autres) partagent leurs expériences aux résultats mitigés (« BEAN », 2013) ou prometteurs (HICKMAN, 2015).
Illustration 8: Traitement du varroa à base de substrat contenant l’acarien prédateur Hypoaspis miles. Le substrat est saupoudré au-dessus des cadres. KOPPERT : Source : https://www.youtube.com/watch?v=RGBnrYVpNEo&feature=youtu.be
4) Le paradoxe de la « mort naturelle » des varroas.
Comme nous l’avons vu précédemment, les varroas se trouvent sur les abeilles (phorésie) ou dans les alvéoles (ontogénèse) en proportions variables selon la saison et la localité principalement. L’estimation de la population de varroas est indispensable à la fois dans son étude et dans son contrôle et de nombreux auteurs se sont penchés sur la comparaison d’indicateurs afin d’effectuer cette estimation. La « chute quotidienne de varroa » (« Daily Mite Drop ») ou « chute naturelle » (« Natural Mite Drop ») ou encore « mort naturelle » (« Daily Dead Mite ») est un des indicateurs fortement corrélé à la population totale de varroas (GHAMDI & HOOPINGARNER, 2004), elle correspond aux varroas se retrouvant sur le socle de la ruche. Cette chute correspond à la mort naturelle des varroas, au comportement de toilettage des abeilles (qui élimine environ 3% des varroas phorétiques chez A.mellifera) (FERNANDEZ ET COINEAU, 2002) et possiblement d’autres phénomènes (LOBB & MARTIN, 1997). Selon les études, le comptage des varroas chutant quotidiennement représente 1,1% de la population totale (BRANCO et al., 2006), 0.9% (CATALYUD & VERDU, 1993) ou 1,2% (LIEBIG et al., 1984 in GHAMDI & HOOPINGARNER, 2004). Pour effectuer cette mesure, on utilise la méthode des langes graissées (« sticky board ») consistant à positionner une planche enduite de graisse en fond de la ruche (illustration 10) : l’objectif de la graisse est d’empêcher les varroas morts d’être soufflés par quelconque courant d’air, le planche est relevée au bout d’un temps t et on rapporte le nombre de varroas comptés sur la planche par le nombre de jours de présence de la planche dans la ruche. C’est cette méthode qui est couramment utilisées pour évaluer l’efficacité d’un traitement, les dynamiques de populations (OSTIGUY & SAMMATARO, 2000) (KRETZSCHMAR et al., 2015)… Le présupposé à toute ces études est que les varroas trouvés sur la planche sont des varroas tombés morts or si un varroa vivant tombe, il reste englué dans la graisse et est aussi compté dans « les varroas morts naturellement », en quel cas, la présence de la lange graissée dans la ruche interfère avec la dynamique de population de varroa et pourrait, peut-être, constituer un biais surévaluant l’efficacité des traitements en conditions expérimentales. Plusieurs études montrent justement que sur les varroas chutant, un certain nombre sont encore vivants : LOBB & MARTIN (1997) comptaient 50% de varroas vivants, WEBSTER & THAKER (1999) dénombraient 60% de varroas vivant après une chute provoquée par un traitement à l’APISTAN®, WEBSTER et al. (2000) comptaient encore 45% à 50% de varroas vivant parmi les chutant en conditions normale, 30% à 45% après un traitement au fluvalinate et 5 à 20% après un traitement au coumaphos. Au-delà de ces résultats, aucune publication ne fait part de la proportion, parmi ces varroas vivants tombés au fond de la ruche, des parasites capables de retourner en phase phorétique et de reprendre un cycle reproductif. Il s’agit probablement d’un part très faible de la population initiale de varroa (de 0 à 0,05%) mais rappelons que quelques varroas résiduels après un traitement suffisent à reconstituer une population importante sur la campagne suivante.

Illustration 8: Traitement du varroa à base de substrat contenant l’acarien prédateur Hypoaspis miles. Le substrat est saupoudré au-dessus des cadres. KOPPERT : Source : https://www.youtube.com/watch?v=RGBnrYVpNEo&feature=youtu.be

Illustration 9: Exemple de la mise en place de langes graissées au fond de la ruche pour mesurer la chute de varroa. Source : http://scientificbeekeeping.com/fighting-varroa-reconnaissance-mite-sampling/

Illustration 10: Lange graissée après une plusieurs jours dans la ruche, on y observe des varroas morts et divers déchets de la ruche, notamment de la cire.
Source http://www.beverlybees.com/ahhh-mites-treating-for-varroa-destructor/
5) Conclusion sur la lutte anti-varroa
L’implacable présence de Varroa destructor dans les ruches d’Apis mellifera du monde entier (à l’exception de certaines localités) montre qu’aucune méthode, technique ne permet de l’éradiquer complétement. Même avec des traitements qui atteignent 99% d’efficacité, les varroas résiduels, les invasions véhiculées par les abeilles et le fort taux de croissance intrinsèque du varroa permettent au parasite de reconstituer rapidement une population compromettant la survie des colonies et la quiétude des apiculteurs. Les groupements de défense sanitaire tournent depuis longtemps leur stratégie de lutte sur un maintien de la population de varroa en dessous d’un niveau dommageable (<1000) (GUILLOTON, 2017). Dans cet objectif, la combinaison des outils de luttes est obligatoire et c’est vers des raisonnements de lutte intégrée que se tourne et doit se tourner la filière apicole, la proportion de ruches insuffisamment protégées pour chaque campagne restant sensiblement élevée (VANDAME, 2015). Chaque contribution et innovation comme le développement de produits de biocontrôle est justifié dans la mesure où ils s’insèrent avec cohérence dans l’éventail des pratiques sanitaires apicoles en vigueur.
Bibliographie
Abeille du Poitou. Varroa destructor: le parasite capable de mimer chimiquement deux espèces. [en ligne]. Disponible sur http://www.abeilledupoitou.fr/evenements/actualites/varroa-destructor-le-parasite-capable-de-mimer-chimiquement-deux-especes-dabeilles/. Consulté le 21.02.2017
ADJLANE N., BENAZIZA D., HADDAD N., 2015. Population dynamic of Varroa destructor in the local haney bee Apis mellifera intermissa in Algeria. Bulletin of pure and applied sciences. Vol.34 A (Zoology), Issue (1-2) 2015:P.25-37. ISSN 2320 3188. [en ligne]. Disponible sur https://www.researchgate.net/publication/286529217_Population_dynamic_of_Varroa_Destructor_in_the_local_honey_bee_Apis_Mellifera_Intermissa_in_Algeria?ev=srch_pub. Consulté le 27.01.2017
ADJLANE N., HADDAD N., TAREK O., 2016. Effectiveness of treatiments with thymol in controlling Varroa destructor parasite of the honey bee in Algerie. Bulletin of pure and applied sciences. Vol.35 A (Zoology), Issue (No.1) 2016:P.1-7. ISSN 0970 0765. [en ligne]. Disponible sur https://www.researchgate.net/publication/304575080_Effectiveness_of_Treatments_with_Thymol_in_Controlling_Varroa_Destructor_Parasite_of_The_Honey_Bee_in_Algeria?ev=srch_pub. Consulté le 31.01.2017
ANSES. Index des médicaments vétérinaires autorisés en France. [en ligne]. Disponible sur http://www.ircp.anmv.anses.fr/. Consulté le 31.01.2017
ANSES. APISTAN Résumé des caractéristiques du produit. [en ligne]. http://www.ircp.anmv.anses.fr/rcp.aspx?NomMedicament=APISTAN. Consulté le 13.02.2017
ANSES. APIVAR Résumé des caractéristiques du produit. [en ligne]. http://www.ircp.anmv.anses.fr/rcp.aspx?NomMedicament=APIVAR. Consulté le 13.02.2017
APPLIED BIO-NOMICS. Stratiolaelaps. [en ligne]. Disponible sur http://www.appliedbio-nomics.com/products/stratiolaelaps/. Consulté le 06.02.2017
“BEAN”, 2013. Mites that might eat mites. [en ligne]. Disponible sur http://pacificnorthwesthoney.com/mites-that-might-eat-mites/. Consulté le 06.02.2017
Beekeeping.freeforums.net. Bees – Working Bees, Queen & Drones. [en ligne]. Disponible sur https://fr.pinterest.com/pin/384283780676759330/. Consulté le 21.02.2017
BRANCO M.R, KIDD N.A.C., PICKARD RS., 2006. A comparative evaluation of sampling methods for Varroa destructor (Acari :Varroidae) population estimation. Apidologie 37 (2006) 452-461 © INRA/DIB-AGIB/EDP Sciences, 2006. DOI: 10.1051/apido:2006010. [en ligne]. Disponible sur https://www.researchgate.net/publication/41712276_A_comparative_evaluation_of_sampling_methods_for_Varroa_destructor_Acari_Varroidae_population_estimation?ev=srch_pub. Consulté le 27.01.2017
CALATAYUD F., VERDU M.J., 1993. Hive debris counts in honeybee colonies: A method to estimate the size of small populations and rate of growth of the mite Varroa jacobsoni Oud. (Mesostigmata: Varroidae). Enperimental and Applied Acarology 17(12):889-894. December 1993. DOI: 10.1007/BF02328065.
CALIS J.N.M, BOOT W.J., BEETSMA J., EIJNDE VAN DEN J., RUIJTER DE A., STEEN VAN DER J., 1999. Journal of Apicultural Research 37(3), January 1999.
CHARRIERE J.D., IMDORF A., FLURI P., 1998. Potentiel et limites de l’acide oxalique pour lutter contre le Varroa. Référencé sous « Acide oxalique par pulvérisation – une méthode hautement efficace pour lutter contre Varroa destructor ». Revue Suisse d’Apiculture n°81/1998 pp311-316. [en ligne]. Disponible sur https://www.researchgate.net/publication/242145043_Acide_oxalique_par_pulverisation_-_une_methode_hautement_efficace_pour_lutter_contre_Varroa_destructor. Consulté le 31.07.2017
DE JONG D., GONCALVES L.S., MORSE R.A., 1984. Dependence on climate of the virulence of Varroa jacobsoni. Bee World (65(3): 117-121 (1984). [en ligne]. Disponible sur
https://www.researchgate.net/publication/277647141_Dependence_on_Climate_of_the_Virulence_of_Varroa_Jacobsoni. Consulté le 27.01.2017
DE LA RUA P., JAFFE R., DALLOLIO R., MUÑOZ I., SERRANO J., 2009 – Biodiversity, conservation and current threats to European honeybees. Apidologie 40, 263-284. [en ligne]. Disponible sur
https://www.researchgate.net/publication/238074946_De_La_Rua_P_Jaffe_R_Dall%27Olio_R_Munoz_I_Serrano_J_Biodiversity_conservation_and_current_threats_to_European_honeybees_Apidologie_40_263-284. Consulté le 26.01.2017
DONZE G., GUERIN P.M., 1994. Behavioral attributes and parental care of Varroa mites parasitizing honeybee brood. Behavioral Ecology and Sociobiology, may 1994, Volume 34, Issue 5, pp 305-319.
FAEZEL-ORR H.K., CATALFAMO K.M., BREWSTER C.C., FELL R.D., ANDERSON T.D., TRAVER B.E., 2016. Effects of pesticide treatments on nutrient levels in worker honey bees (Apis mellifera). Insects 2016, 7, 8 ; DOI:10.3390/insects7010008. [en ligne]. Disponible sur https://www.researchgate.net/publication/296625201_Effects_of_Pesticide_Treatments_on_Nutrient_Levels_in_Worker_Honey_Bees_Apis_mellifera. Consulté le 30.01.2017
FAUNA EUROPAEA. Varroa jacobsoni Oudemans, 1904. [en ligne]. Disponible sur http://www.fauna-eu.org/cdm_dataportal/taxon/ad52624b-f78e-42cd-a6fa-0ea09d013d6d. Consulté le 26.01.2017
FFAP. Les Priorités de la FFAP : Proposition d’action pour le programme de l’ITSAP. [en ligne]. Disponible sur http://www.apipro-ffap.net/component/jdownloads/send/6-analyses-et-contributions-ffap/49-programme-itsap-propositions-ffap-27-02-2013. Consulté le 24.01.2017
FFAP. Présentation de la Fédération Française des Apiculteurs Professionnels. [en ligne]. Disponible sur http://www.apipro-ffap.fr/component/jdownloads/send/25-la-ffap/161-presentation-ffap. Consulté le 25.01.2017
FERNANDEZ N., COINEAU Y., 2002. Varroa Tueur d’abeilles Bien le connaître, pour mieux le combattre. Atlantica, Anglet, 2002 – ISBN : 2-84394-438-4- N°archive : 928.
FNOSAD La Santé de l’Abeille. Informations sanitaires. [en ligne]. Disponible sur http://fnosad.apiservices.biz/14-accueil/9-informations-sanitaires. Consulté le 24.01.2017
FROST E.H., SHUTLER D., HILLIER N.K., 2013. Effects of fluvalinate on honey bee learning, memory, responsiveness to sucrose and survival. The Journal of Experimental Biology, 216, 2931-2938 © 2013. Published by the Company of Biologists Ltd. [en ligne]. Disponible sur https://www.researchgate.net/publication/236338534_Effects_of_fluvalinate_on_honey_bee_learning_memory_responsiveness_to_sucrose_and_survival. Consulté le 30.01.2017
GHAMDI A.A., HOOPINGARNER R., 2004. Development of the mite, Varroa jacobsoni Oud., in the honeybee, Apis mellifera L., in Michigan, USA, and a comparison of diagnostic methods for detection of mites. Arab Gulf Journal of Scientific Research, 22 (1), pp 1-8 (2004). [en ligne]. Disponible sur
https://www.researchgate.net/publication/286815433_Development_of_the_mite_Varroa_jacobsoni_Oud_in_the_honeybee_Apis_mellifera_L_in_Michigan_USA_and_a_comparison_of_diagnostic_methods_for_detection_of_the_mites. Consulté le 27.01.2017
GAUTHIER B 2011. UPV. Les vétérinaires « volent » au secours des abeilles. Union Professionnelle Vétérinaire. [en ligne]. Disponible sur http://www.upv.be/actualites/~les-veterinaires-volent-au-secours-des-abeilles.htm?lng=fr. Consulté le 25.01.2017
GUILLOTON J.A., 2017. Vétérinaire du Groupement Départemental Sanitaire de Loire Atlantique, titulaire du diplôme Inter-Ecoles en Apiculture et Pathologie Apicole (ONIRIS-Nantes Atlantique). Correspondance électronique et téléphonique.
GRIFFITHS D.A., BOWMAN C.E., 1981. World distribution of the mite Varroa jacobsoni a parasite of honeybee. Bee World 62(4): 154-163.
HICKMAN S, 2015. Bio Control Varroa mite. Vidéo. [en ligne]. https://www.youtube.com/watch?v=rcVbtplV9oQ. Consulté le 06.02.2017
ILYASOV R.A., FARKHUTDINOV R.G., SHAREEVA Z.V., 2014. Influence of acaricides amitraz and fluvalinate on average daily egg and total honey productivity of honey bee colonies. Биомика, 2014, Том 6, № 2, 73-76. [en ligne]. Disponible sur
https://www.researchgate.net/publication/270282046_Influence_of_acaricides_amitraz_and_fluvalinate_on_average_daily_egg_and_total_honey_productivity_of_honey_bee_colonies?ev=srch_pub. Consulté le 30.01.2017
IMDORF A., CHARRIERE JD., 1996. Alternative varroa control. American bee journal 136-3): 189-193. March 1996. [en ligne]. Disponible sur
https://www.researchgate.net/publication/285540380_Alternative_varroa_control. Consulté le 31.01.2017
IMDORF A., CHARRIERE J.D., KILCHENMANN V., BOGDANOV S., FLURI P. 2003. Alternative strategy in central Europe for the control of Varroa destructor in honey bee colonies. Swiss Bee Research Centre.[en ligne]. Disponible sur
https://www.researchgate.net/publication/237117113_Alternative_strategy_in_central_Europe_for_the_control_of_Varroa_destructor_in_honey_bee_colonies. Consurlté le 27.01.2017
INFANTIDIS M.D., 1998. Some aspects of the process of Varroa jacobsoni mite entrance into honey bee (Apis mellifera) brood cells. Apidologie, 1988, 19(4), 387-394. [en ligne]. Disponible sur
https://www.researchgate.net/publication/46269832_Some_aspects_of_the_process_of_Varroa_jacobsoni_mite_entrance_into_honey_bee_Apis_mellifera_brood_cells. Consulté le 26.01.2017
KAMLER M., NESVORNA M., STARA J., ERBAN T., HUBERT J., 2016. Comparison of tau-fluvalinate, acrinathrin, and amitraz effects on susceptible and resistant populations of Varroa destructor in a vial test. Experimental and Apply Acarology 2016. DOI 10.1007/s10493-016-0023-8. © Springer International Puplishing Switzerland 2016. [en ligne]. Disponible sur https://www.researchgate.net/publication/295901787_Comparison_of_tau-fluvalinate_acrinathrin_and_amitraz_effects_on_susceptible_and_resistant_populations_of_Varroa_destructor_in_a_vial_test?ev=srch_pub. Consulté le 30.01.2017.
KEVAN P. G., LAVERTY T. M., DENMARK H. A. 1190 – Association of Varroa jacobsoni with organisms other than honeybees and implications for its dispersal. Bee World 71(3): 119-121 (1990). [en ligne]
https://www.researchgate.net/publication/261913126_Association_of_Varroa_Jacobsoni_With_Organisms_Other_Than_Honeybees_and_Implications_for_its_Disposal. Consulté le 26.01.2017
KOPPERT BIOLOGICAL SYSTEME. ENTOMIT-M. [en ligne]. Disponible sur
https://www.koppert.fr/ravageurs/thrips/produits-contre-les/entomite-m/
Consulté le 24.01.2017
KOVAC H., KAFER H., STABENTHEINER A., COSTA C., 2014. Metabolism and upper thermal limits of Apis mellifera carnica and A.m. ligustica. Apidologie (2014) 45:664-677. DOI: 10.1007/s13592-014-0284-3. [en ligne]. Disponible sur:
https://www.researchgate.net/publication/267982913_Metabolism_and_upper_thermal_limits_of_Apis_mellifera_carnica_and_A_m_ligustica. Consulté le 10.02.2017.
KRAUS B., PAGE R.E., 1995. Population growth of Varroa jacobsoni Oud. in Mediterranean climates of California. Apidologie 26(2) 149-157. January 1995.
KRETZSCHMAR A., DURAND E., MAISONNASSE A., VALLON J., LE CONTE Y., 2015. A new stratified sampling procedure which decreases error estimation of varroa mite number on sticky boards. Journal of Economic Entomology 108(3): 14535-1443 (2015); DOI:10.1093/jee/tov077. [en ligne]. Disponible sur
https://www.researchgate.net/publication/276127949_A_New_Stratified_Sampling_Procedure_which_Decreases_Error_Estimation_of_Varroa_Mite_Number_on_Sticky_Boards. Consulté le 02.02.2017
L’ABEILLE DU POITOU. APIVAR® Amitraz. [en ligne]. Disponible sur http://www.abeilledupoitou.fr/apivar-amitraz/. Consulté le 02.03.2017
LANTUEJOUL C., 2017. Vétérinaire du Groupement Départemental Sanitaire de Loire Atlantique, titulaire du diplôme Inter-Ecoles en Apiculture et Pathologie Apicole (ONIRIS-Nantes Atlantique). Correspondance électronique et téléphonique.
LE CONTE Y., ARNOLD G., TROUILLER J., OURISSON G., 1989. Attraction of the parasitic mite varroa to the drone larvae of honey bees by simple aliphatic esters. Science 245(4918):638-9 – September 1989.
LOBB N., MARTIN S., 1997. Mortality of Varroa jacobsoni Oudemans during or soon after the emergence of worker and drone honeybees Apis mellifera L.. Apidologie (1997) 28. 367-374. © Elsevier/Inra/DIB/AGIB. DOI: 10.1051/apido:19970604. [en ligne]. Disponible sur
https://www.researchgate.net/publication/229087601_Mortality_of_Varroa_jacobsoni_Oudemans_during_or_soon_after_the_emergence_of_worker_and_drone_honeybees_Apis_mellifera_L. Consulté le 02.02.2017
MAGGY M.D., DAMIANI N., RUFFINENGO S.R., BRASECO M.C., SZAWARSKI N., MITTON G., MARIANI F., SAMMATARO D., QUINTANA S., EGUARAS M.J., 2016. The susceptibility of Varroa destructor against oxalic acid: a study case. Bulletin of Insectology 70, December 2016. [en ligne]. Disponible sur
https://www.researchgate.net/publication/311909899_The_susceptibility_of_Varroa_destructor_against_oxalic_acid_a_study_case. Consulté le 31.01.2017
MARTIN S. 1998. A population model for the ectoparasitic mite Varroa jacobsoni in honey bee (Apis mellifera) colonies. Ecological Medelling 109 (1998) 267-281. [en ligne]. Disponible sur
https://www.researchgate.net/publication/222473529_A_population_model_for_the_ectoparasitic_mite_Varroa_jacobsoni_in_honey_bee_Apis_mellifera_colonies_Ecological_Modelling_109. Consulté le 27.01.2017
MAIDANA N.A., BENAVENTE M.A., EGUARAS M., 2005. A model in differential equations to describes the mite Varroa destructor population dynamic in Apis mellifera colonies. Foro-Red-Mat: Revista electronica de contenido matematico, ISSN 1405-1745, Vol. 16, N°9, 2005. [en ligne]. Disponible sur http://www.red-mat.unam.mx/foro/volumenes/vol016/varroa.pdf. Consulté le 27.01.2017
MASS J., MARKX J., 2015. Biological control of Varroa destructor using the predatory mite Stratiolaelaps scimitus. Department Applied Biology of HAS University of Applied Sciences, 's-Hertogenbosch. The Netherlands. [en ligne]. Vidéo disponible sur www.youtube.com/watch?v=mgUB0E5MDbw. Consulté le 24.01.2017
MELATHOPOULOS A.P., CUTLER G.C., TYEDMERS P., 2014. Where is the value in valuing pollination ecosystem services to agriculture? Ecological Economics 109 (2015) 59-70. [en ligne]. Disponible sur
https://www.researchgate.net/publication/268521332_Where_is_the_value_in_valuing_pollination_ecosystem_services_to_agriculture. Consulté le 26.01.2017
Ministère de l’agriculture, de l’agroalimentaire et de la forêt, 2013. Plan de Développement durable de l’apiculture. [en ligne]. Disponible sur http://agriculture.gouv.fr/sites/minagri/files/pddapiculture_vf.pdf. Consulté le 25.01.2017
OSTIGUY N., SAMMATARO D., 2000. A simplified technique for counting Varroa jacobsoni Oud. On sticky boards. Apidologie 31 (2000) 707-716 © INRA/DIB-AGIB/EDO Sciences. [en ligne]. Disponible sur https://www.researchgate.net/publication/248855335_A_simplified_technique_for_counting_Varroa_jacobsoni_Oud_on_sticky_boards?ev=srch_pub. Consulté le 02.02.2017
Padil.gov.au. Pests and diseases. Asiatic honeybee. [en ligne]. Disponible sur http://www.padil.gov.au/pests-and-diseases/pest/main/135533/67. Consulté le 21.02.2017
PIC2FLY. Results for APISTAN. [en ligne]. Disponible sur http://www.pic2fly.com/Apistan.html. Consulté le 03.03.2017
RADAKOVIC M., STEVANOVIC J., NINOSLAV D., NADA L., JELENA KV. BRANKA V.G, STANIMIROVIC Z., 2013. Evaluation of the DNA damaging effects of amitraz on human lymphocytes in the Comet assay. Journal of Biosciences 38(1):53-62. January 2013
RANGEL J. 2016. Evaluation of the predatory mite Stratiolaelaps scimitus for biological control of the honey bee ectoparasitic mite Varroa destructor. Conference Paper: 2016 International Congress of Entomology. (Résumé de l’article uniquement). [en ligne]. Disponible sur https://esa.confex.com/esa/ice2016/meetingapp.cgi/Paper/95186. Consulté le 03.02.2017
ROSENKRANZ P., AUMEIER P., ZIEGELMANN B., 2009. Biology and control of Varroa destructor. Journal of Invertebrate Pathology 103 (2010) S96-S119.
RUCHE WARRE. forum. Plancher grillagé antivarroa. Disponible sur http://www.ruchewarre.net/viewtopic.php?t=188&start=15. Consulté le 20.02.2017.
SCHAFFER W.M, JENSEN D.B., HOBBS D. E., GUREVITCH J., TODD J.R., SHAFFER M.V., 1979. Competition, foraging energetics, and the cost of sociality in three species of bees. Ecology 60(5):976. October 1979
SCHMEHL D.R., ELLIS J.D., 2014. The identification of miticide resistance in varroa mites and the development of novel varroa control strategies for improving honey bee health. Conference Paper. Entomological Society of America. Annual Meeting 2014.
SPRYGIN A.V., BABIN Yu.Yu., KHANBEKOVA E.M., ROBTSOOVA L.E., 2016. Varroa destructor and a threat of viral infections of the honeybee (Apis mellifera L.). In agrobiology 2016.2.156.
VANDAME J. 2015. FNOSAD. Test d’efficacité 2015. LSA n° 273 • 5-6/2016. [en ligne]. Disponible sur http://gdsa34.e-monsite.com/medias/files/test-d-efficacite-2015-lsa-273-pp-193-216.pdf. Consulté le 26.01.2017
VANDAME R, COLIN M-E., MORAND S., OTERO-COLINA G., 2000. Levels of compatibility in a new host-parasite association: Apis mellifera/Varroa jacobsoni. Canadian Journal of Zoology. 78: 2037-2044 (2000). [en ligne]. Disponible sur https://www.researchgate.net/publication/237968837_Levels_of_compatibility_in_a_new_host-parasite_association_Apis_melliferaVarroa_jacobsoni. Consulté le 27.01.2017
Véto-pharma, engagé pour l’apiculture. Varroa destructor : biologie et mode d’action. [en ligne]. Disponible sur http://www.veto-pharma.fr/produits/lutte-contre-varroa/varroa-destructor/. Consulté le 21.02.2017
WEBSTER T.C., THACKER E.M, 1999. Fall of live Varroa mites from honey bee colonies. Proc. Apimondia Congr. 36: 97-98.
WEBSTER T.C. THACKER E.M., VORISEK F.E., 2000. Live Varroa jacobsoni (Mesostigmata : Varroidae) fallen from honeybee (Hymenoptera : Apidae) colonies. Journal of economic entomology(93)6: 1596-1601 (2000). DOI: 10.1603/0022-0493-93.6.1596.
WENDLING S.L.P., 2012. Varroa destructor (Anderson et Trueman, 2000), un acarien ectoparasite de l’abeille domestique Apis mellifera Linnaeus, 1758. Revue bibliographique et contribution à l’étude de sa reproduction. Thèse pour le Doctorat vétérinaire. Ecole Nationale vétérinaire d’Alfort. [en ligne]. Disponible sur http://theses.vet-alfort.fr/telecharger.php?id=1490. Consulté le 27.01.2017
WESTPHAL C., BOMMORCO R., CARRE G., LAMBORN E., MORISON N., PETANIDOU T., POTTS S.G., ROBERTS S.P.M., RGYI H.S., TSCHEULIN T., VAISSI B.E., WOYCIECHOWSKI M., BIESMEIJER J.C., KUNIN W., SETTELE J., 2008. Measuring bee diversity in different European habitats and biogeographical regions. Ecological Monographs, 78(4), 2008, 99 653-671 © 2008 by Ecological Society of America. [en ligne]. Disponible sur
https://www.researchgate.net/publication/228773827_Measuring_bee_diversity_in_different_European_habitats_and_biogeographical_regions. Consulté le 30.01.2017
WIKIPEDIA. Liste des maladies animales à déclaration obligatoire en France. [en ligne]. Disponible sur https://fr.wikipedia.org/wiki/Liste_des_maladies_animales_%C3%A0_d%C3%A9claration_obligatoire_en_France. Consulté le 26.01.2017



